
1.地壳中含量最多的元素是
A.氧B.硅C.铝D.钙
2.物质的下列性质中,属于化学性质的是
A.颜色B.状态 C.熔点D.氧化性
3.下列图标中表示禁止吸烟的是
A.  B.
B.  C.
C.  D.
D. ![]()
4.下列金属中,金属活动性最弱的是
A.金 B.银C.铜 D.铁
5.能用酒精灯直接加热的仪器是
A.漏斗B.量筒C.试管 D.烧杯
6.我国科技创新成果卓越,下列成果中获得诺贝尔奖的是
A.侯德榜发明联合制碱法
B.屠呦呦发现抗疟新药青蒿素
C. 闵恩泽研发石油炼制催化剂
D.张青莲主持测定了几种元素相对原子质量的新值
7.下列物质由分子构成的是
A.锌B.硫酸铜C.C60 D.金刚石2017年江苏省中考化学试题
8.下列行为会增加空气中PM2.5的是
A.治理工地扬尘 B. 露天焚烧垃圾
C. 使用公共自行车 D.禁止焚烧秸杆
9.下列关于干冰升华过程的说法正确的是
A.二氧化碳分子的体积变大B. 二氧化碳分子的质量变小
C.二氧化碳分子的种类改变D.二氧化碳分子间的间隔变大
10.实验室制取某些气体的装置如图。下列说法正确的是
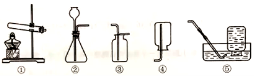
A.装置①和⑤组合可以用来制取氧气 B.装置②和③组合可以用来制取氢气
C.装置②和④组合可以用来制取二氧化碳 D.装置②可以较好地控制反应速率
11.下列材料中属于复合材料的是
A.不锈钢 B.聚氯乙烯 C.玻璃钢D.天然橡胶
12.下列叙述不正确的是
A.用蒸馏的方法,可以得到净化程度较高的水
B.用食醋浸泡鸡蛋的方法,可以制得无壳鸡蛋
C.用灼烧闻气味的方法,可以试分棉制品和羊毛制品
D.用喷水的方法,可以扑灭所有物质燃烧引起的火灾
13.下列各组离子在水中能大量共存的是2017年江苏省中考化学试题
A.Cu2+、Na+、Cl-、OH- B.H+、+、NO3-、SO42-
C.Na+、NH4+、NO3-、OH-D.Ag+、Ba2+、NO3-、Cl-
14.除去下列物质中混有的少甘杂质(括号内为杂质),拟定的实验方案不可行的是
A. FeCl2溶液(CuCl2) ——加入过量的铁粉,过滤
B.KCl固体(KClO3)——加入少量的二氧化锰,并加热
C.CO气体(CO2)——通过足量的氢氧化钠溶液,并干燥
D. NaCl溶液(MgCl2) ——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性
15.按右图所示装置,持续通入气态物质X,可以看到玻璃管中有红色物质生成,无水CuSO4变蓝,澄清石灰水变浑浊,则X不可能是

A.氢气和水蒸气与B.氢气和二氧化碳
C.一氧化碳和氛气 D.一氧化碳和水蒸气
二、(本题包括2小题,共13分)
16. (6分)2017年5月,我国首次海域可燃冰试采成功,可燃冰外观像冰,主要含有甲烷水合物(由甲烷分子和水分子组成),还含少量二氧化碳等物质。
(1)可燃冰属于_______(填“纯净物”或“混合物”)。
(2)化学家在较低的温度和压力下,用甲烷等为原料制成了金刚石薄膜,该变化属于_____(填“物理变化”或‘化学变化”)。
(3)甲烷(CH4)可用作燃料,其充分燃烧的化学方程式为_________。
(4)常温常压时,由甲烷和另两种气体组成的混合物中,碳元素的质量分数为80%,则另两种气体可能是________。
A.H2和COB. H2和C2H2C. C2H2和C2H4 D.CO和C2H4
17. (7分)溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是_________。
A.只有固体B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制100g质量分数为16%的氯化钠溶液,所需氯化钠的质量为________,水的体积为________mL (水的密度近似看作1g/cm3)。
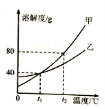
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如右图. t1℃时,甲物质的溶解度是________。t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是________(填“甲”或“乙”)物质的饱和溶液。
 www.ccutu.com
www.ccutu.com
(4)按右图所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。则可能的组合是______。
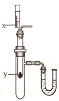
选项 | x | y |
A | 水 | 氧化钙 |
B | 水 | 硝酸铵 |
C | 浓硫酸 | 水 |
D | 稀盐酸 | 镁 |
三、(本题包括1小题.共14分)
18.(14分)核电菏数为1~18的元素的原子结构示意图等信息如下,请回答下列间题、

(1)2017年5月9日,中国科学院等单位联合发布了115号元素的中文名为“镆”。此元素原子的核电荷数为______,核外电子数为______。
(2)在第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是_________。
(3)利用上表中给出的元素,写出含有氮元素的常见单质、氧化物、酸、键、盐的化学式各一个,并标出所写化学式中氮元素的化合价:单质______、氧化物______、酸______、碱______、盐______。
(4)以钠和氯为例,简述结构与性质的关系。________________________。
(5)国产C919大型客机上使用了大量的铝合金。工业上用电解氧化铝(Al2O3)得到铝和氧气、试计算电解102t氧化铝最多能生成铝的质量是多少?(在答题卡上写出计算过程)
四、(本题包括2小题,共12分)
19.(5分)空气中氧气含量测定的经典赏析。
教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图)。

(1)写出汞与氧气反应的化学方程式_________________。
(2)本实验中选择使用汞的优点有:2017年江苏省中考化学试题
①汞在加热的条件下,只和氧气反应。②汞为液态,在汞槽中起到液封的作用,并能直接用来测见反应器内空间体积的变化。
③生成的氧化汞分解又能得到汞和氧气中,把得到的氧气加到剩下的4/5体积的气体中,结果所得气体跟空气的性质完全一样。
根据资料卡片,请再补充本实验使用汞的两个优点,并说明依据。
④_____________。 ⑤_____________。
(3)通过实验,拉瓦锡得出了空气由氧气和氮气组成,其中氧气约占空气总体积1/5的结论。请根据现在的认识,对此结论予以补充。_________________________________。www.ccutu.com
20. (7分)右图中A-I表示初中化学常见的物质,且分别是由一种或两种元家组成:其中A、B、D、H均为单质;F可用作大棚蔬菜生产中的气体肥料;H在B、F、G存在的情况下可以生成铜绿[铜绿主要成分为Cu2(OH)2CO3]。图中“--”表示两端的物质间能发生化学反应:“→” 表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。

(1)写出化学式:F______, H_______。
(2)实验室常用E制取B,写出该反应的化学方程式__________________。
(3)反应①和②的基本反应类型相同,该基本反应类型是____________。
(4) 写出A→C反应的化学方程式_________________。
五、(本题包括1小题,共11分)
21.(11分)兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
查阅资料:
pH | 7.5~9 | 10~11.9 | 12~14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
【得出结论1】三种溶液的碱性由强到弱的顺序为________________。
【实验探究2】甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由_____色变为____色。向其中加入稀盐酸,该反应的化学方程式为__________________。
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示. 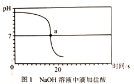
【得出结论2】从微观角度分析,该反应的实质是______________________。
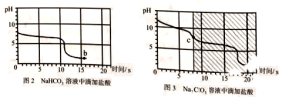
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得列pH变化与时间的关系如图2、图3所示。
 2017年江苏省中考化学试题
2017年江苏省中考化学试题
【交流与反思】b点的溶质为_______(写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质______(写化学式)
【得出结论3】通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:_________、__________________。
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识www.ccutu.com反应的原理及进行的过程。

一、选择题(本题每小题只有一个选项符合题意。每小题2分,共30 分)
1-5:ADDAC6-10:BCBDA 11-15:CDBBA
二、(本题包括2小题,共13分)
16.(本题共6分)
(1)混合物(2)化学变化(3)CH4+2O2![]() CO2+2H2O(4)BCD
CO2+2H2O(4)BCD
17. (本题共7分)(1) D ;(2) 16g 84g(3)40g 乙 (4) AD
三、(本题包括l小题,共14分)
18. (本题共14分)
(1)115 115 (2)最外层电子数依次递增
(3) ![]()
(4) (问答要点)最外层电子数、得失电子与化学性质之间的关系
(5)54t
四、(本题包括2小题,共12分)
19.(本题共5 分)
(1)2Hg+O2![]() 2HgO(2) 汞的沸点较低,汞蒸气与氧气反应比较充分,能将密闭装置内空气中的氧气几乎耗尽。氧化汞的密度小于汞,且不溶于汞,因此易与汞分离。
2HgO(2) 汞的沸点较低,汞蒸气与氧气反应比较充分,能将密闭装置内空气中的氧气几乎耗尽。氧化汞的密度小于汞,且不溶于汞,因此易与汞分离。
(其他合理答案均给分)www.ccutu.com
(3)空气的成分按体积计大约是:氧气21%、氮气78%、稀有气体等其他成分1%。
20. (本题共7分)
(1) CO2 Cu(2) 2H2O2![]() 2H2O+O2↑ (3)置换反应(4) H2+Cl2
2H2O+O2↑ (3)置换反应(4) H2+Cl2![]() 2HCl
2HCl
五、(本题包括l小题,共11分)
21. (本题共11分)
【得出结论1】氢氧化钠溶液>碳酸钠溶液>碳酸氢钠溶液
【实验探究2】无红NaOH+HCl=NaCl+H2O pH=7,恰好完全反应
【得出结论2】 氢离子和氢氧根离子结合生成水分子
【交流与反思】NaCl、HClNaCl、NaHCO3
【得出结论3】Na2CO3+ HCl=NaCl+ NaHCO3NaHCO3+NaOH= Na2CO3+ H2O
![]()

2019中考在即,各省市的中考时间都不是统一规定的,下文有途网小编给大家整理了2019江苏各市的中考时间安排在什么时候,以及中考的考试科目包...

2018年暑假即将到来,今年的江苏初中学生暑假是从什么时候开始,到什么时候结束?下文有途网小编给大家整理了江苏2018初中学的暑假放假时间安...

2017年盐城市中考物理试题(含答案)

2017年无锡市中考英语试题(含答案)

2017年苏州市中考物理试题(含答案)

2017年苏州市中考历史试题(含答案)

2017年江苏省中考英语试题(含答案)

中考过后,同学们最关心的就是自己分数能够上哪些高中,下面是由有途网小编指南整理的盐城市的部分高中分数预测,仅供参考,具体以官网公布为准。希望...

中考过后,同学们最关心的就是自己分数能够上哪些高中,下面是由有途网小编指南整理的连云港市的部分高中分数预测,仅供参考,具体以官网公布为准。希...

中考过后,同学们最关心的就是自己分数能够上哪些高中,下面是由有途网小编指南整理的徐州市的部分高中分数预测,仅供参考,具体以官网公布为准。希望...

2017中考即将到来,中考是检测初中在校生是否达到初中学业水平的水平性考试和建立在九年义务教育基础上的高中选拔性考试;是初中毕业证发放的必要...

九年寒窗,一朝及第。中考成绩一分一操场的情况已成定局。考生应抱有每分必争,尽量不失分的原则参加考试。下面是由有途网整理的2017年无锡市中考...

九年寒窗,一朝及第。中考成绩一分一操场的情况已成定局。考生应抱有每分必争,尽量不失分的原则参加考试。下面是由有途网整理的2017年盐城市中考...

九年寒窗,一朝及第。中考成绩一分一操场的情况已成定局。考生应抱有每分必争,尽量不失分的原则参加考试。下面是由有途网整理的2017年淮安市中考...

九年寒窗,一朝及第。中考成绩一分一操场的情况已成定局。考生应抱有每分必争,尽量不失分的原则参加考试。下面是由有途网整理的2017年徐州市中考...